主要信息
论文题目:Rapid, automated, and reliable antimicrobial susceptibility test from positive blood culture by CAST‐R
发表期刊:mLife《微生物》
发表时间:2022年4月18日
作者单位:中国科学院青岛生物能源与过程研究所、北京协和医院、青岛星赛生物科技有限公司、青岛大学附属医院、广州生物岛实验室

摘要
多重耐药菌(MDR)和其耐药性的传播已成为全球性的公共卫生问题,MDR引起的血流感染往往病情较重,快速完成药敏检测并采取有针对性的治疗措施,对于降低患者的死亡率至关重要。但是,目前病原药物敏感性试验(AST)耗时很长,不能满足感染性疾病及时诊断的需要,导致临床医生主要依赖经验进行治疗。针对这一难题,研究人员以替加环素治疗败血症的AST为主要模型,利用星赛生物的临床单细胞拉曼药敏快检仪(CAST-R),基于重水标记单细胞拉曼光谱技术(D2O-SCRS),将常见病原体(血液感染阳性培养瓶内)的AST时长缩短至3小时,实现了十倍加速,可在培养瓶报阳当天得出药敏结果。CAST-R内置自动化液体处理工作站(PLS),可实现一站式样品D2O孵育、自动清洗和芯片定位,同步实现细胞精准定位、高通量拉曼光谱自动采集及智能化光谱质量控制。CAST-R的自动化、快速性、可靠性和普遍适用性表明它在指导临床使用抗菌素方面具有潜在的效用。
前言
败血症是指病原菌侵入血液循环而引发的急性全身性感染,死亡率高达20%-40%,在引起血流感染的病原体中,鲍曼不动杆菌最为常见。作为一种广谱抗菌药物,替加环素被誉为抗感染治疗的最后选择。目前,许多病原体(如鲍曼不动杆菌)已经出现了对替加环素的耐药性,同时药敏试验的检测周转时间(TAT,从医生申请检验项目到收到检验报告的时间)每延迟一小时,死亡率就会提高7.6%。因此,在治疗败血症时,急需快速、可靠、可临床应用的AST新策略。
针对多重耐药或泛耐药病原体(如鲍曼不动杆菌或碳青酶烯类耐药肠杆菌目等细菌)感染,替加环素往往是针对抗感染治疗的最后一道防线,然而临床检测病原体对替加环素的药敏性面临诸多难点。首先,替加环素理化性质不稳定,易氧化分解。同时,培养基的类型、配制时间、检测方法、不同的菌种以及折点的选择等因素,都对替加环素的体外药敏结果有影响。其次,目前的药敏方法存在较多的难点和操作误区,不易标准化。
研究结果
1. CAST-R的全流程自动化
全流程的自动化是CAST-R的显著特点之一(图1A,B)。血液样本在血培养瓶中培养12-24小时,选取其中的阳性培养瓶(PBC)进行AST。阳性培养瓶内样品一式两份,一份利用CAST-R进行药敏评价,另一份利用MALDI-TOF识别病原体(作为CAST-R病原体识别结果的参考;图1B)。
CAST-R工作流程如下:CAST-R中的自动化液体处理工作站(PLS)一站式完成样品D2O孵育、自动清洗和芯片定位;仪器内置的软件(自主研发的算法)实现细胞精准定位与高通量拉曼光谱采集;结合机器学习实现了光谱采集过程的自动化和智能化以及光谱的质量控制,通过计算eMIC-MA指数得出准确药敏结果。
整个AST过程从PBC开始仅需要3小时,而基于培养法的AST(如VITEK 2、E-test、BMD等),通常超过48小时。
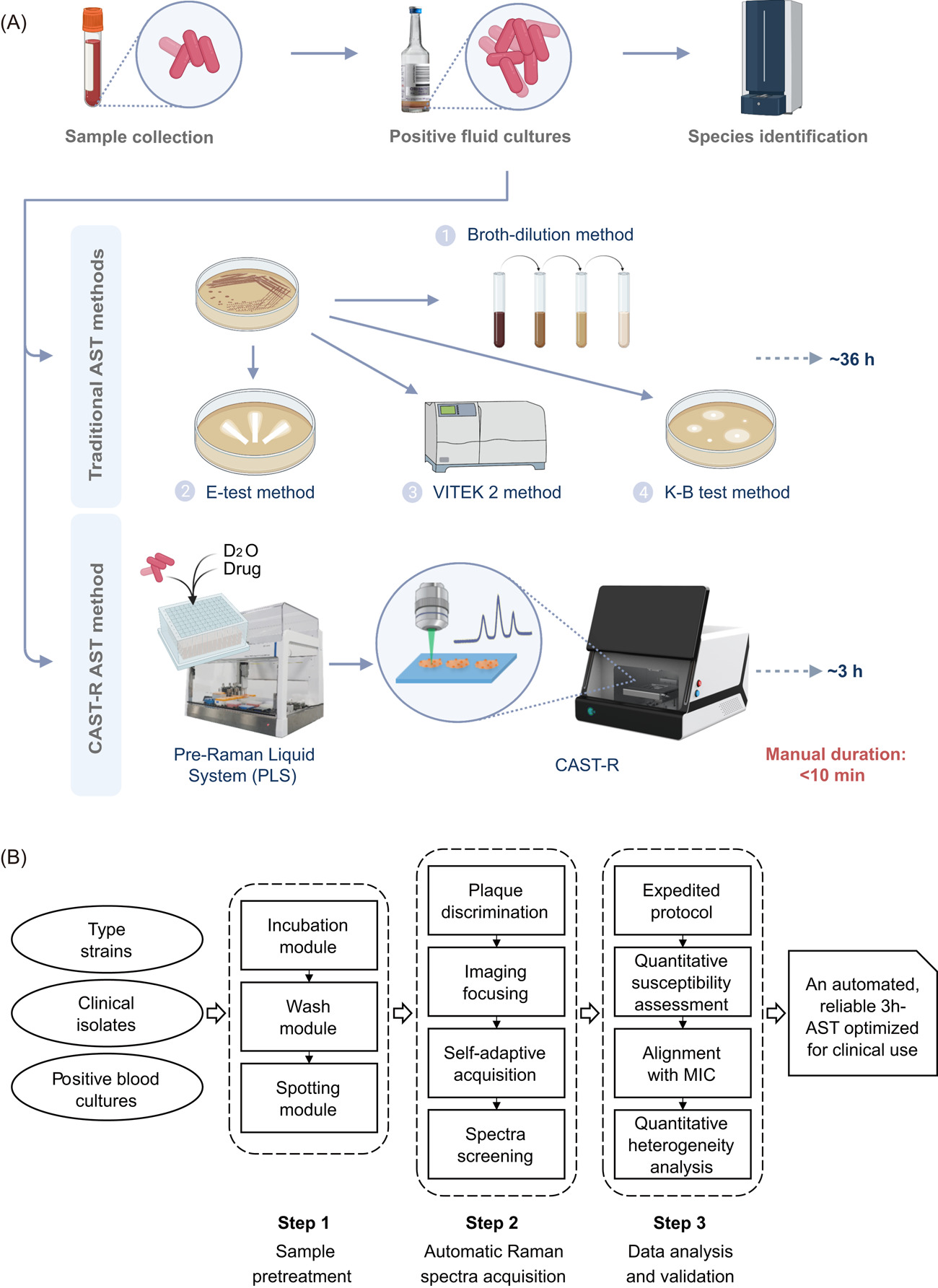
图1. CAST-R的自动化工作流程。(A)CAST-R工作流程与传统药敏检测工作流程的区别(以临床血液样本的药敏检测流程为例)。(B)CAST-R开发过程中面临的挑战与对应的解决方案。
样品预处理的自动化
基于拉曼光谱的AST,需要先对样品进行预处理,该过程费时费力,包括:1)配制抗生素重水溶液并孵育细胞;2)多次清洗细胞,以排除背景信号的干扰,通常需要20分钟;3)将孵育、清洗后样品点在CaF2芯片上,形成菌斑,并精确获取拉曼光谱,这对低生物量样品(<104 CFU/mL)至关重要。
CAST-R内置自动化液体处理工作站PLS,由孵育模块、清洗模块、点样模块组成,采用8通道移液器结合96孔抗菌试验药敏板进行样品转移和培养。PLS在96孔过滤板内进行自动样品清洗,在疏水石英芯片进行自动化点样以提高检测点的细胞密度,在一张芯片上可采集多个样品的拉曼光谱。利用PLS进行自动化样品预处理的总时间可缩短至5分钟以内。
高质量拉曼图谱采集和质量控制的自动化
目前市面上的拉曼光谱仪在样品检测过程中仍需要人工操作,且拉曼光谱采集质量取决于操作者的经验,不适合大规模临床样品检测。而CAST-R的内置软件支持自动化、高通量拉曼光谱采集,包括菌斑识别、自动图像聚焦、自动光谱采集以及光谱质量自动评估和筛选等功能。
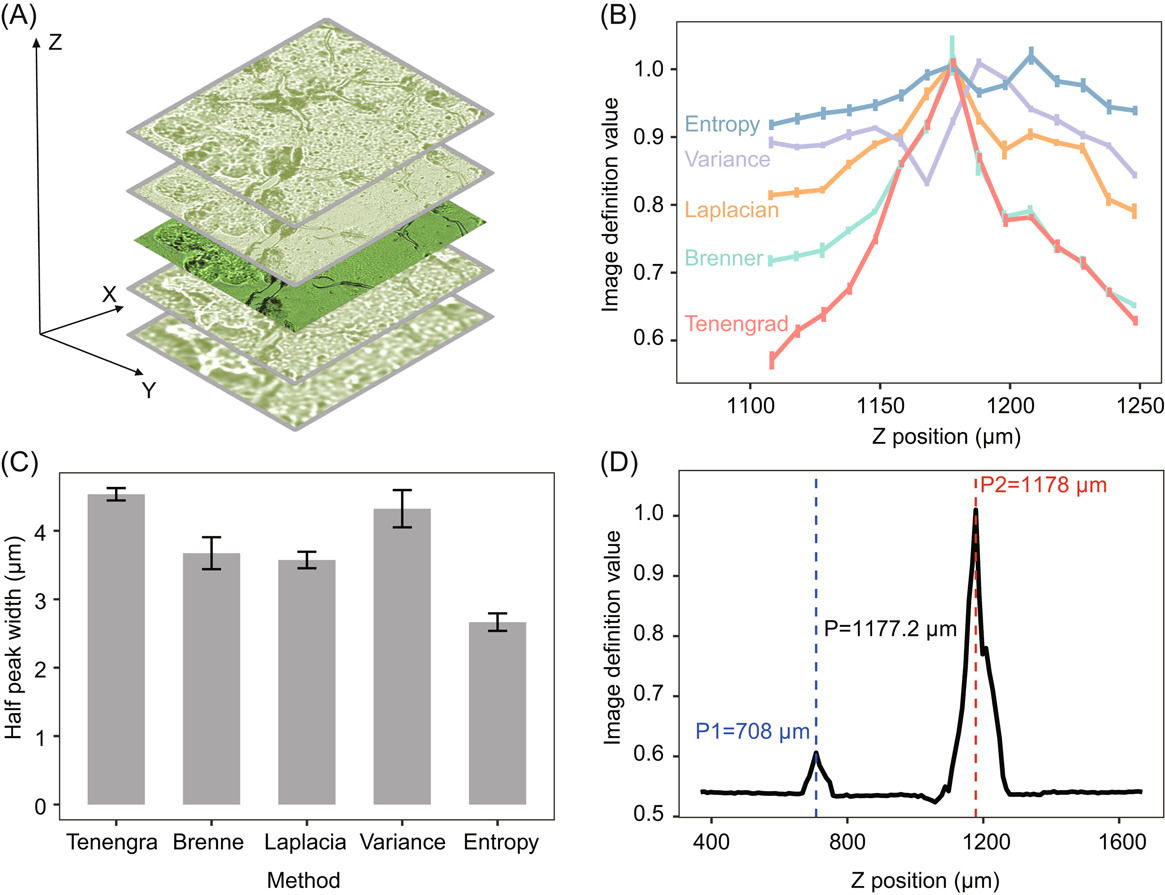
图2. CAST-R中的自动化、智能化光谱采集。(A)基于细胞图像的自动聚焦过程。(B)用不同图像清晰度评价方法对聚焦过程中的图像进行清晰度计算。(C)不同图像清晰度评价方法的半峰全宽(FWHM)。(D)Tenengrad定位效果。P1(708 μm)是局部最大清晰度位置,P2(1178 μm)是Tenengrad确定的最佳位置。P2接近实际最佳聚焦位置P(1177.2 μm)。
2. 药物敏感性测量的新概念“eMIC-MA”
临床实验室标准化研究所CLSI和美国食品药品监督管理局FDA的AST解释标准中,不动杆菌属对替加环素的敏感性暂无明确的MIC折点说明,欧洲抗菌药敏试验委员会(EUCAST)将替加环素对不动杆菌属的流行病学折点定为0.5 mg/L。本研究最初将不动杆菌属对替加环素的MIC折点设定为≤0.5 mg/L为敏感型(S),≥1 mg/L为耐药型(NS)。
实验测定了不同浓度替加环素孵育下细胞的拉曼光谱,发现鲍曼不动杆菌敏感株(S)在0.5 mg/L替加环素刺激下没有明显的C-D峰(2040-2300 cm-1),而鲍曼不动杆菌耐药株(NS)在0.5 mg/L替加环素刺激下存在明显的C-D峰(图3A),因此上述MIC折点的设定适用于利用CAST-R对鲍曼不动杆菌进行敏感型、耐药型的分辨。
本研究提出一个创新的概念eMIC-MA,其通过代谢抑制水平(MIL)曲线计算得出。首先,引入MIL定量抗生素处理后细胞的代谢抑制程度,其中

然后,确定合适的MIL折点以推导eMIC-MA。如图3B所示,在0.5 mg/L替加环素处理下,敏感株与耐药株的MIL显著不同,且MIL为0.8时,能最大程度区分敏感株与耐药株,准确度较高(AUC=0.983,图3C),因此MIL的折点确定为0.8。最后,eMIC-MA定义为替加环素刺激2小时后平均MIL≥0.8的替加环素最小浓度。结果表明,两种鲍曼不动杆菌菌株的eMIC-MA分别为0.5和1 mg/L,与BMD测得的MIC相同。
通过替加环素预孵育、EUCAST折点合适性判定和eMIC-MA定义,CAST-R能够在3小时内测定鲍曼不动杆菌的替加环素AST。

图3. 使用CAST-R通过eMIC-MA检测鲍曼不动杆菌对替加环素的敏感性。(A)不同剂量替加环素孵育2小时后,比较S和NS菌株单细胞拉曼光谱(SCRS)上C-D峰的区别。(B)S和NS菌株的拉曼光谱计数与不同剂量之替加环素孵育2 h后的代谢抑制水平(MIL)的关系。红色虚线(0.8)是区分S和NS菌株的标准。(C)根据0.5 mg/L替加环素孵育下ROC曲线区分S和NS菌株。AUC,曲线下面积;S,敏感菌株;NS,耐药菌株。
临床分离株的AST验证了CAST-R的准确性和可靠性
研究人员分析了100株鲍曼不动杆菌临床分离株对替加环素的药敏性,这些基于eMIC-MA的AST结果与基于MIC的结果相比,分类一致率(CA)为93%(93/100;图4)。同时,几乎所有临床分离株的eMIC-MA都与BMD法测量的MIC相同,基本一致率(EA)为99%(99/100;图4),验证了CAST-R的准确性和可靠性。

图4. 比较鲍曼不动杆菌临床分离株(n=100)的MIC和eMIC-MA。通过eMIC-MA和MIC得出的替加环素药敏性具有较高的一致性,基本一致率为99%(99/100,结果相同的用蓝色或红色标记),分类一致率为93%(93/100,结果不同的用下划线标记)。
血培养阳性培养瓶的AST验证CAST-R的检测速度和可靠性
向PBC中加入氯化铵钾(ACK)裂解液,孵育、离心后加入0-8 mg/L替加环素,分别利用CAST-R、传统BMD方法测定AST。结果表明,基于CAST-R的AST测量过程大约需要3小时,而BMD大约需要36小时,说明CAST-R在AST检测上实现了十倍加速。与BMD结果相比,CAST-R针对14个PBC的AST结果分类一致率为92.8%(13/14,图5),验证了CAST-R测量PBC的AST的可靠性。
3. CAST-R的普适性
研究人员针对26例患者血培养阳性培养瓶,测定了常见血流感染菌(大肠杆菌、肺炎克雷伯菌、金黄色葡萄球菌和鲍曼不动杆菌)对8种抗生素的药物敏感性,包括替加环素、美罗培南、头孢他啶、氨苄西林/舒巴坦、苯唑西林、克林霉素、万古霉素和左氧氟沙星。与BMD结果相比,分类一致率达到93%(80/86),验证了CAST-R在血流感染用药上的广谱适用性。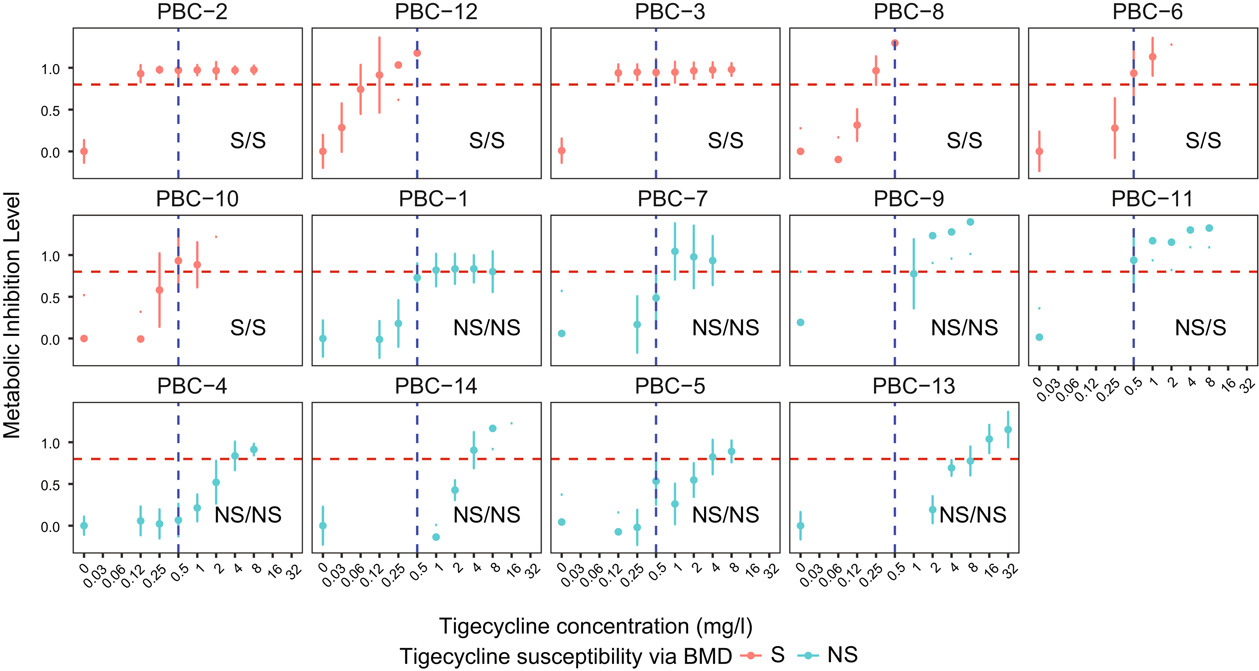
图5. 利用CAST-R对鲍曼不动杆菌血液感染阳性培养瓶中样品进行药敏检测(AST)。样品中鲍曼不动杆菌的替加环素代谢抑制水平(MIL)存在剂量依赖性。替加环素浓度范围是0~8 mg/L。红色虚线(0.8)是确定eMIC-MA的分界线。每个子图的右下角,展示了通过微量肉汤稀释法(BMD)(左)或CAST-R(右)的替加环素药敏结果。S,敏感菌株;NS,耐药菌株。所有样品均基于3次平行试验。
总结
星赛生物的临床单细胞拉曼药敏快检仪CAST-R,基于重水标记单细胞拉曼光谱技术(D2O-SCRS),实现了自动化的样本预处理和基于深度学习算法的高质量图谱采集。在与临床金标准BMD得出结果一致的情况下,大大缩短了药敏试验的时间,全流程可在3小时内完成,仅为目前检测时长的1/10。
该研究验证了自动化CAST-R系统的灵敏性、可靠性、准确度与临床适用性,加速了其临床应用。单细胞拉曼光谱在表型解析方面仍有很多优势尚待开发利用,后期星赛生物计划通过引入流式拉曼光谱分析技术(FlowRACS)(点击查看),有望进一步加快药敏检测的速度;同时,利用单细胞拉曼分选耦合测序技术(RACS-Seq)(点击查看),可在单细胞精度建立耐药表型和基因型的联系,从而跟踪超级细菌的出现与耐药性的传播。














 鲁公网安备37021202001515
鲁公网安备37021202001515


