海洋是地球上最大的活跃碳库,海洋微生物在全球碳循环中起着至关重要的作用,然而由于大部分海洋微生物尚难以培养、原位代谢功能难以测量等技术瓶颈,业界对于海洋微生物光合固碳的原位功能机制等重要问题,仍然存在争议。
中国科学院青岛生物能源与过程研究所与英国牛津大学、英国谢菲尔德大学、青岛星赛生物科技有限公司、山东省海洋科学研究院等合作,基于CO₂固定活性靶向性的拉曼分选耦合单细胞基因组(scRACS-Seq)等仪器手段,揭示了海水中原位进行光合固碳的SAR11类群,并发现它们以视紫红质作为捕光系统来驱动海水中CO₂的固定。相关成果已于近日发表在BioDesign Research《生物设计研究》。
为了识别海洋微生物组中哪些细胞在原位固定CO₂,单细胞中心荆晓艳高级工程师、公衍海助理研究员和徐腾博士带领的研究小组,利用稳定同位素¹³C标记的无机碳底物饲喂新鲜海水样品,通过单细胞拉曼光谱中类胡萝卜素等色素特征峰的“红移”现象,建立了在免培养前提下原位固定CO₂之单细胞的识别和测量流程。基于单细胞中心与星赛生物联合研制的scRACS-Seq系统,建立了针对CO₂固定活性等代谢表型的功能靶向性单细胞拉曼分选与测序方法。
运用该scRACS-Seq体系,研究人员在中国山东省青岛崂山湾真光层海水中,识别和分选到一系列进行海洋原位固碳代谢的Pelagibacter属单细胞,来自于SAR11等类群。基于这些SAR11单细胞全基因组序列(覆盖度最高达到100%)的进化分析、基因功能预测与代谢途径重建表明:1)它们具有完整的类胡萝卜素合成途径,这印证了上述单细胞拉曼光谱基于色素峰红移来识别和表征CO₂固定活性的原理;2)发现了一个基于视紫红质的光激活质子泵系统,其中包括双加氧酶(Dioxygenase enzyme)、视紫质光敏感蛋白(Proteorhodopsin)、F-型ATP合成酶(F-type ATPase)等关键蛋白;3)它们拥有大部分进行CO₂固定的Calvin-Benson循环途径的基因。这些发现提示,这些SAR11细胞,可能通过基于视紫红质的光激活质子泵系统,来驱动基于Calvin-Benson循环的海水原位固碳。为了验证这一假设,研究人员将这些SAR11单细胞基因组中四个预测为视紫质光敏感蛋白的基因在大肠杆菌中进行了异源表达。结果证实,它们能够合成视紫质且其中的两个基因与GenBank中的基因均无显著同源性,属于一类全新的视紫质光敏感蛋白。因此,这些视紫红质介导的光激活质子泵系统,很可能是SAR11在海水中原位进行光合固碳的能量引擎。
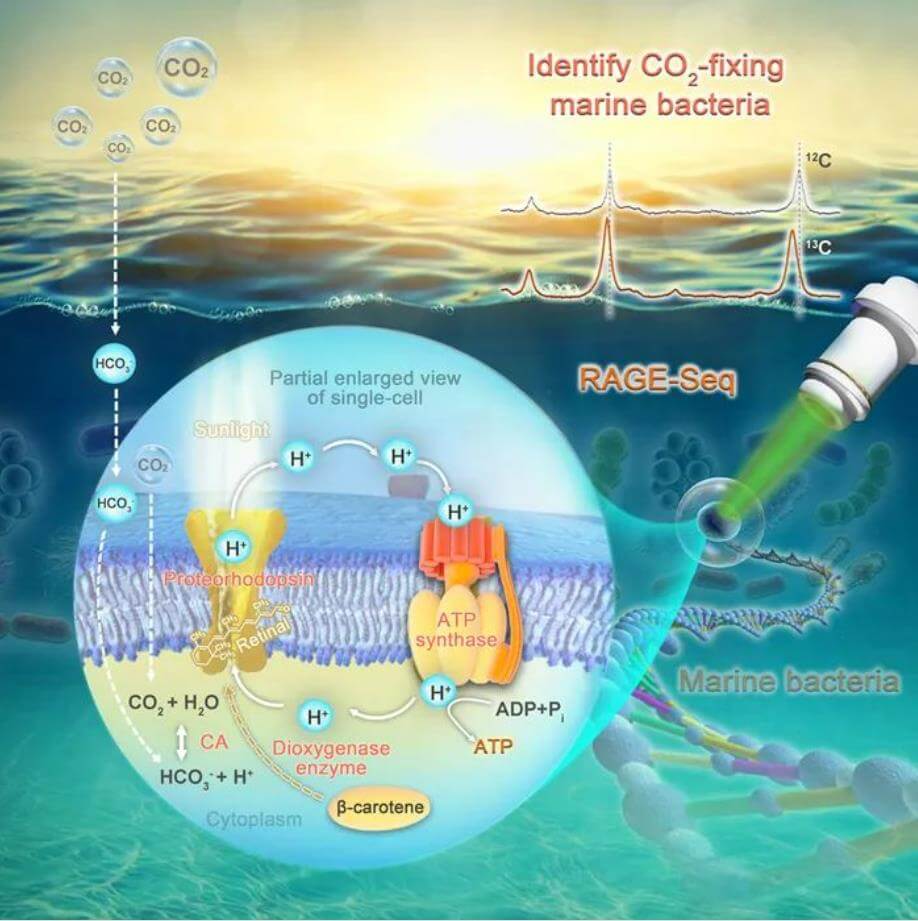
单细胞精度的海洋微生物组功能靶向性拉曼分选与测序技术(scRACS-Seq)
SAR11难以培养且研究工具匮乏,本研究在单细胞精度同时揭示了SAR11的代谢表型组和完整基因组,从而建立了视紫质光敏感蛋白和海水原位CO₂固定之间的功能关联。这一原创的“拉曼介导靶向单细胞基因组”(scRACS-Seq)仪器体系,克服了目前“拉曼介导靶向元基因组”手段通常难以在单个细菌细胞精度获得高覆盖度基因组这一瓶颈问题,因此对于环境中生命暗物质的功能探索和机制解析具有共性的方法学意义。
该工作由英国牛津大学工程科学系黄巍教授和青岛能源所单细胞中心徐健研究员联合主持,与英国谢菲尔德大学Neil Hunter教授等团队合作完成,并得到了国家重大科学仪器研制项目、青岛星赛生物等的支持。














 鲁公网安备37021202001515
鲁公网安备37021202001515


